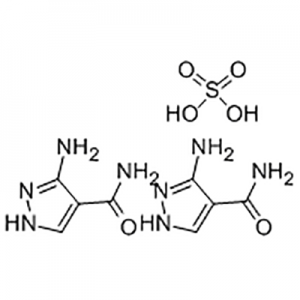
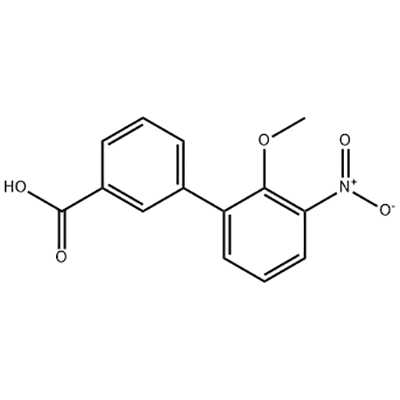
חומצה 2'-מתוקסי-3'-ניטרו-ביפניל-3-קרבוקסילית
חומצה 2'-מתוקסי-3'-ניטרו-ביפניל-3-קרבוקסילית
חומצה 2'-מתוקסי-3'-ניטרו-ביפניל-3-קרבוקסילית משמשת כתוצר הביניים של אלטרומבופג.
Eltrombopag, שפותח על ידי GlaxoSmithKline (GSK) בבריטניה ומאוחר יותר פותח במשותף עם Novartis בשוויץ, הוא האגוניסט לקולטן TPO מולקולות קטנות, לא פפטידי, הראשון והיחיד בעולם.אלטרומבופג אושר על ידי ה-FDA האמריקאי בשנת 2008 לטיפול בפורפורה אידיופטית טרומבוציטופנית (ITP), ובשנת 2014 לטיפול באנמיה אפלסטית חמורה (AA).זוהי גם התרופה הראשונה שאושרה על ידי ה-FDA האמריקאי לטיפול ב-AA ב-30 השנים האחרונות.
בדצמבר 2012, ה-FDA האמריקאי אישר את אלטרומבופג לטיפול בטרומבוציטופניה בחולים עם הפטיטיס C כרונית (CHC), כך שחולי הפטיטיס C עם פרוגנוזה גרועה עקב ספירת טסיות נמוכה יכולים להתחיל ולשמור על טיפול סטנדרטי מבוסס אינטרפרון במחלות כבד.ב-3 בפברואר 2014, הודיעה GlaxoSmithKline כי ה-FDA העניק את ההסמכה לטיפול פורצת דרך של אלטרומבופג לטיפול בהמופניה בחולים עם אנמיה כימיבוק אפלסטית חמורה (SAA) שלא הגיבו באופן מלא לאימונותרפיה.ב-24 באוגוסט 2015, ה-FDA האמריקאי אישר את אלטרומבופג לטיפול בטרומבוציטופניה במבוגרים וילדים מגיל שנה ומעלה עם טרומבוציטופניה חיסונית כרונית (ITP) שאין להם תגובה מספקת לקורטיקוסטרואידים, אימונוגלובולינים או כריתת טחול.ב-4 בינואר 2018, אלטרומבופג אושרה להירשם בסין לטיפול בטרומבוציטופניה חיסונית ראשונית (ITP).



![פנטמתילן ביס[1-(3,4-דימתוקסי-בנזיל)-3,4-דיהידרו-6,7-דימתוקסי-1H-איזוקינולין-2-פרופיונאט], דיוקסלט](http://cdn.globalso.com/jindunchem-med/image281-300x300.png)

![Casp ungin Acetate;Caspofungin acetate;Cancidas;Caspofungin Acetate [USAN:BAN:JAN];](http://cdn.globalso.com/jindunchem-med/fbe17385-300x300.jpg)